تا به حال به این فکر کرده اید که چگونه دانش شیمی خود را روی آن بکار ببرید چگونه صابون خود را درست کنیم، درک فرآیند؟
درست کردن صابون در خانه یک راه سرگرم کننده و حیله گر برای به دست آوردن تجربه شیمی دست اول و لذت بردن از ثمره کارتان است.
صابون سازی و صابون سازی مفاهیم شیمی زیادی را در بر می گیرد:
- اسیدها، بازها و نمک ها
- بیوشیمی: لیپیدها
- شیمی آلی: استرها، اسیدهای کربوکسیلیک و الکل ها
- هیدرولیز
- امولسیون
- فعل و انفعالات هیدروفیل/آب گریز
اما نترسید – فرآیند واقعی ساخت صابون خانگی ساده تر از آن چیزی است که فکر می کنید!
برای خلاصه ای از ادامه مطلب را بخوانید شیمی پشت صابون سازی، واکنش شیمیایی که در ساخت صابون استفاده می شود و علم نحوه عملکرد صابون. بیشتر این مفاهیم در هر کتاب درسی شیمی آلی که در اینجا مرور کردهایم بسط داده شده است.
در غیر این صورت، برای یک دستور العمل صابون DIY ساده برای مبتدیان به انتهای پست بروید.
این یک آزمایش سرگرم کننده با بچه ها است، اما همیشه تحت نظارت! اگر میخواهید با کودکان شیمی انجام دهید، مطمئن شوید که یکی از بهترین مجموعههای شیمی برای کودکان و بزرگسالان را تهیه کنید!
شیمی صابون سازی: صابونی سازی
واکنش شیمیایی که صابون تولید می کند آنقدر قدیمی و مشخص است که نام آن در لغت به معنای واقعی کلمه است تبدیل شدن به صابون.
صابون سازی، از جانب ساپوکلمه لاتین صابون، یکی از واکنش های شیمیایی به یاد ماندنی است که در ترم اول شیمی آلی به دلیل کاربردهای آشکار آن در زندگی روزمره آموخته شد.
در اینجا خلاصه ای از واکنش کلی است
ابتدا با یک تری گلیسیرید (مولکول های چربی موجود در آن) شروع می کنیم روغن های گیاهی و چربی های حیوانی). یک پایه قوی اضافه می شود که پیوندهای استری تری گلیسیرید را به سه اسید کربوکسیلیک و گلیسراکسید می شکند. در نهایت، پس از تبادل پروتون، محصولات سه نمک اسید کربوکسیلیک و گلیسرول هستند.
توضیح مکانیسم واکنش صابونی سازی
صابون سازی یک هیدرولیز قلیایی یک استر است. ممکن است به یاد داشته باشید که تشکیل یک استر یک واکنش کم آبی بین کربوکسیلیک اسید و الکل است.
در بیوشیمی، این واکنش یک تری گلیسیرید از سه زنجیره اسید چرب آزاد و یک مولکول گلیسرول ایجاد می کند. صابون سازی از یک پایه قوی برای خنثی کردن آن واکنش استفاده می کند. ما این و واکنش های ساده دیگر را در این بررسی آموزشی در مورد مفاهیم شیمی آلی بررسی کرده ایم.
به یاد داشته باشید که یک کربن کربونیل، مانند کربن موجود در یک پیوند استری، به دلیل رزونانس و الکترونگاتیوی بیشتر اکسیژن پیوند، بار مثبت جزئی دارد. به همین دلیل خوب است هدف حمله هسته دوست توسط یون هیدروکسید. محصول این مرحله یک واسطه ارتواستر است (به بار منفی روی اکسیژن کربوکسیل سابق توجه کنید).
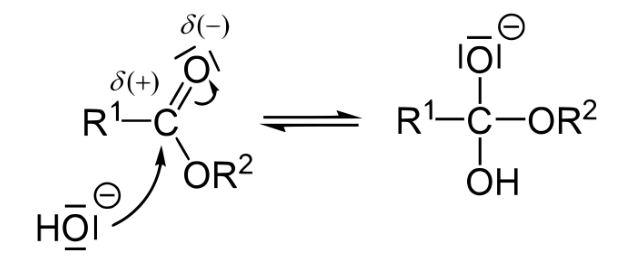


به یاد داشته باشید که اکسیژن زمانی پایدارتر است که دارای دو پیوند و دو جفت تک الکترون باشد. آن الکترون ها برای دستیابی به این پایداری مجدداً مرتب می شوند، اصلاح پیوند دوگانه با کربن برای ساخت اسید کربوکسیلیک و خارج کردن نیمه دیگر استر به صورت آلکوکسید، در مرحله دوم به نام “حذف” (پایه مزدوج یک الکل).
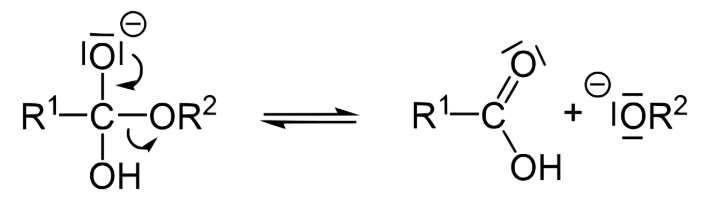


می دانیم که الکل ها به طور کلی اسیدهای بسیار ضعیفی هستند. بنابراین، بازهای مزدوج آنها، آلکوکسیدها، بسیار قوی هستند. در نتیجه تبادل پروتون صورت می گیرد و پروتون اسیدی کربوکسیلیک اسید به آسانی به آلکوکسید اهدا می شود. این منجر به تشکیل یک الکل به اضافه نمک سدیم یا پتاسیم کربوکسیلیک اسید می شود.
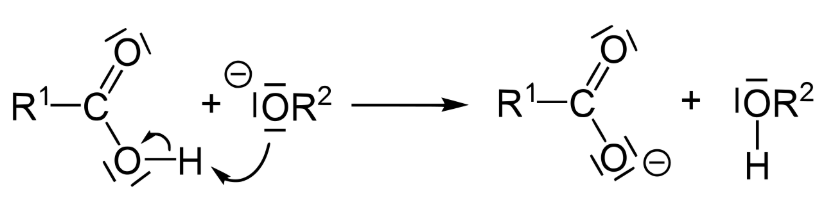
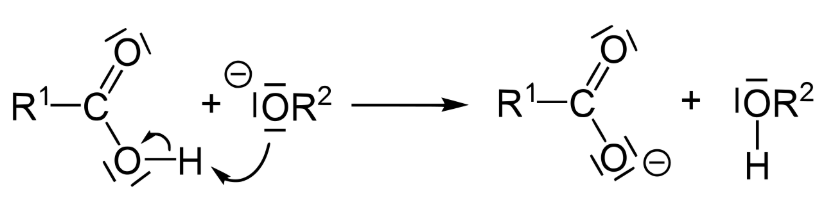
محصولات صابونی سازی
همین واکنش در حال وقوع است هر سه پیوند استری در یک تری گلیسیرید در طول صابون سازی سه نمک اسید چرب به دست آمده به عنوان نمک صابون نیز شناخته می شوند. خواص آنها به شدت به تعداد کربن در زنجیره اسیدهای چرب و درجه اشباع بستگی دارد.
زنجیره های کربنی طولانی تر (مثلاً اسید استئاریک، C18) تمایل به تولید صابون هایی دارند که سخت تر و کمتر محلول هستند.
از سوی دیگر، اسیدهای چرب غیراشباع الف صابون نرم تر با نقطه ذوب پایین تر. برخی از نمک های اسید چرب بیشتر پاک کننده هستند تا حالت دهنده و برعکس. به طور مشابه، برخی از آنها کف خوب و غنی ایجاد می کنند، در حالی که برخی دیگر این کار را نمی کنند. هنگام تصمیم گیری در مورد استفاده از چربی ها و روغن ها در دستور پخت صابون، توجه به این اثرات مهم است.
صابون چگونه کار می کند؟
به ساختار مولکولی این نمک صابون نگاهی بیندازید:
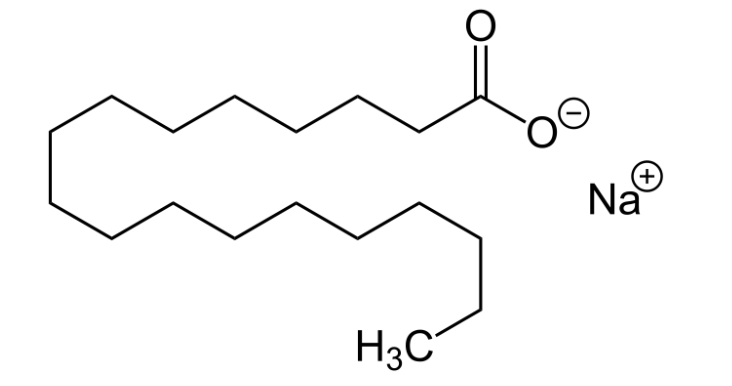


آیا این مولکول قطبی است یا غیرقطبی است؟ پاسخ این است که هر دو! در سمت راست بالا، کربوکسیلات، که به عنوان آنیون در این نمک سدیم عمل می کند، یک گروه عملکردی بسیار قطبی است. با این حال، بقیه آن زنجیره هیدروکربنی طولانی غیر قطبی است.
به این نوع ترکیبات آمفیپاتیک می گویند.
همه می دانند که روغن و آب با هم مخلوط نمی شوند، اما همه نمی دانند که دلیل این امر قطبیت (یا فقدان آن) هر ماده است. به عنوان یک دانشجوی شیمی، احتمالاً قبلاً یاد گرفته اید که مانند، مانند را حل می کند، و آن مولکول های قطبی آبدوست هستند (آب دوست) در حالی که مولکول های غیر قطبی آبگریز (آب ترس) هستند.
احتمالاً میتوانید ببینید که این به کجا میرود… صابون با اجازه دادن به مواد آبگریز، مانند گریس و روغن، در آب حل میشود. دو انتهای آن، یکی قطبی و دیگری غیرقطبی، به آن اجازه می دهد تا با آب و روغن مخلوط شود. این کار را با تشکیل انجام می دهد ساختارهای کروی کوچکی به نام میسل.
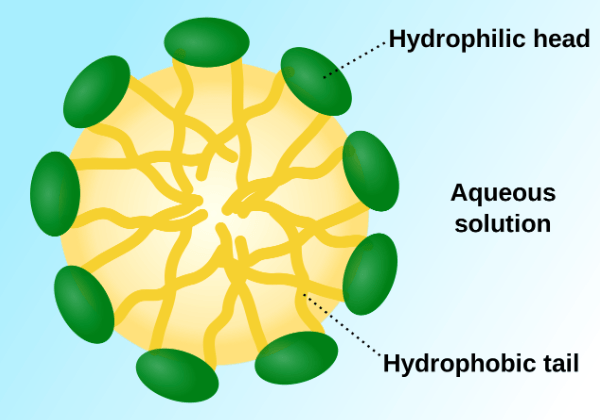


در این مقطع از یک میسل، می توانید زنجیره های هیدروکربنی آبگریز (غیر قطبی) را در داخل کره مشاهده کنید، در حالی که انتهای آب دوست (قطبی) سطح را تشکیل می دهند. هنگامی که یک ماهیتابه چرب را با آب صابون می شویید، گریس به انتهای آبگریز جذب می شود، آن را درون این میسل ها به دام می اندازد. از آنجایی که سطح میسل قطبی است، در آب محلول است و اکنون می توان آن را به راحتی شستشو داد.
صابون همچنین یک سورفکتانت طبیعی است، به این معنی که کشش سطحی آب را کاهش می دهد. به طور موثر آب را “تر” می کند. هر چه آب “مرطوب تر” باشد، خواص حلال آن بهتر است و بهتر تمیز می شود.
شیمی در خانه: چگونه صابون خود را بسازیم
حالا بیایید این همه دانش شیمی را عملی کنیم و کمی صابون خانگی درست کنیم!
این دستور تهیه صابون DIY (این کار را خودتان انجام دهید). بسیار ابتدایی است که برای مبتدیان عالی است. شما به برخی تجهیزات اولیه و چند ماده اولیه به راحتی در دسترس نیاز دارید:
تجهیزات صابون سازی
- عینک و دستکش ایمنی
- ترازوی اشپزخانه
- پارچ*
- شیشه*
- قابلمه یا کاسه بزرگ*
- دماسنج
- قاشق همزن*
- مخلوط کن غوطه وری (میکسر استیک)
- کاردک لاستیکی
- قالب های صابون
* مطمئن شوید که از مواد غیر واکنشی مانند پلاستیک یا شیشه استفاده می کنید.
شما می توانید توصیه های شخصی ما در مورد آزمایشگاه شیمی خانگی را در اینجا بیابید. ایده آل است که بتوانید از فنجان ها یا فلاسک های مناسب برای این آزمایش استفاده کنید. اما اگر هنوز به آنها دسترسی ندارید، میتوانید از وسایل خانهای که در بالا ذکر شده است خلاص شوید.
لیمو سوزاننده است (بسیار اساسی) و می تواند با بسیاری از چیزها واکنش نشان دهد، مانند فلزات (یا شما پوست!). این واکنش گرمازا است و تغییر سریع دما ممکن است باعث ترک خوردن ظروف شیشه ای با کیفیت پایین شود.
مواد اولیه صابون:
- 500 گرم روغن زیتون
- 100 گرم روغن نارگیل
- 80 گرم لیمو (NaOH، سود سوزآور)
- 200 میلی لیتر آب
به خاطر داشته باشید که در حالی که شما می توانید از هر نوع روغن یا چربی برای تهیه صابون استفاده کنید، اما آنها را خواهند داشت خواص بسیار متفاوتی دارد و ممکن است به مقادیر متفاوتی از لیمو نیاز داشته باشد. اگر از روغنهای مختلف استفاده میکنید، مطمئن شوید که از یک ماشین حساب لیسک استفاده میکنید تا مطمئن شوید که بیش از حد استفاده نمیکنید. وجود روغن اضافی در صابون شما مشکل بزرگی نیست، اما داشتن شیره اضافی است!
دستورالعمل ها:
- محلول لیمو/NaOH را آماده کنید. آب داخل پارچ را وزن کنید. به طور جداگانه، NaOH را در شیشه وزن کنید. سپس به آرامی NaOH را به آب اضافه کنید. آب را به لیمو اضافه نکنید! به یاد داشته باشید که چگونه آنها شما را مجبور کردند “اسید را به آب اضافه کنید، نه آب به اسید” را در ماژول ایمنی آزمایشگاه شیمی خود حفظ کنید؟ در مورد پایه ها هم همینطور. یک باز قوی مانند NaOH طبق تعریف بسیار واکنش پذیر است. این بدان معناست که هنگام تماس با آب انرژی زیادی آزاد می شود. اگر این مرحله را به عقب انجام دهید، مخلوط به سرعت گرم می شود. این ممکن است به یک آبفشان سود سوزآور ختم شود که به راحتی می تواند باعث سوختگی شیمیایی شود. وقتی NaOH را به آب اضافه میکنید، باز هم گرما آزاد میشود، اما خطر بسیار کمتری خواهد داشت. با دقت هم بزنید تا حل شود (قاشق را بلافاصله پس از مخلوط شدن بشویید). این محلول به خودی خود می تواند تقریباً به دمای جوش برسد، بنابراین ممکن است لازم باشد اجازه دهید کمی خنک شود تا بتوانید به راحتی پارچ را کنترل کنید.
- روغن های خود را وزن کرده و در قابلمه یا کاسه مخلوط کنید. اگر ابتدا روغن نارگیل را کمی گرم کنید تا ذوب شود، این کار آسان تر خواهد بود.
- محلول NaOH را با دقت به مخلوط روغن اضافه کنید و به آرامی با قاشق هم بزنید تا مخلوط یکدستی به دست آید.
- حالا می توانید چوب مخلوط کن خود را بیرون بکشید و فرآیند امولسیون سازی را شروع کنید. به یاد داشته باشید، شما در حال حاضر یک مخلوط بسیار سوزاننده را مخلوط می کنید، بنابراین فاصله خود را حفظ کنید و سعی کنید پاشیده نشوید.
- پس از چند دقیقه مخلوط کردن، مخلوط باید شروع به غلیظ شدن کند، که نشان می دهد واکنش صابونی سازی در حال انجام است. به صورت اختیاری، این زمانی است که میتوانید مواد دیگری را برای سفارشی کردن صابون خود اضافه کنید، مانند روغنهای ضروری، رنگها، مخلوطها و غیره. در غیر این صورت، میتوانید ادامه دهید. انتقال صابون به هر چیزی که به عنوان قالب استفاده می کنید. قالب های پخت سیلیکونی برای این کار عالی هستند. از یک کاردک لاستیکی برای بیرون آوردن آخرین ذره و تسهیل تمیز کردن استفاده کنید.
- اجازه دهید صابون خود را برای حداقل 24 ساعت سفت شود قبل از اینکه سعی کنید آن را از قالب خارج کنید. هنگامی که به اندازه کافی سخت شد، در صورت تمایل می توانید آن را به اشکال/اندازه های مختلف برش دهید.
- در نهایت، صابون نیاز دارد حدود یک ماه درمان شود برای اطمینان از کامل بودن واکنش صابونی و خشک کردن آب اضافی. پس از درمان کامل، می توانید از استفاده از صابون خانگی خود لذت ببرید!
و تقریباً همین است! همانطور که می بینید، این یک روش آسان است.
اکنون که می دانید چگونه صابون خود را بسازید، و شیمی پشت آن را فهمیدید، وقت آن است که روش آزمایشی را عملی کنید!
اگر سوال یا پیشنهادی دارید در نظرات با ما در میان بگذارید. همچنین، با خیال راحت نتایج اولین دسته صابون خود را به اشتراک بگذارید!
